鐵納米氧化物由於其良好的磁共振造影性能和生物相容性已被批準用於臨床腫瘤診斷,但近期意昂4体育平台張春富課題組發現鐵納米氧化物在調節腫瘤微環境和腫瘤代謝、促進腫瘤治療方面也扮演非常積極的角色👮🏽♂️,相關研究已於近期相繼發表在領域重要期刊Advanced Functional Materials 和ACS Nano。
免疫檢查點抑製療法(ICB)是目前腫瘤免疫治療的主導方法,對某些特定癌症療效顯著,但並不是對所有癌症普遍有效♥️。越來越多的證據表明,ICB反應性與腫瘤免疫微環境(TIME)密切相關。特別地,對於缺乏腫瘤浸潤性淋巴細胞(TIL)向腫瘤核心浸潤的“非炎症”或“排除型”腫瘤,ICB療法具有低響應性和不良預後。因此👼,促進腫瘤內TILs的積累對於提高目前ICB療法的療效至關重要。除了基於T細胞的免疫治療之外,激活腫瘤相關巨噬細胞(TAMs)來攻擊腫瘤細胞近年來也引起了廣發的關註🌨。TAMs長期以來被認為完全來源於骨髓來源的單核細胞前體,導致目前基於巨噬細胞的免疫治療主要停留在調節TAMs的總群體🪣。
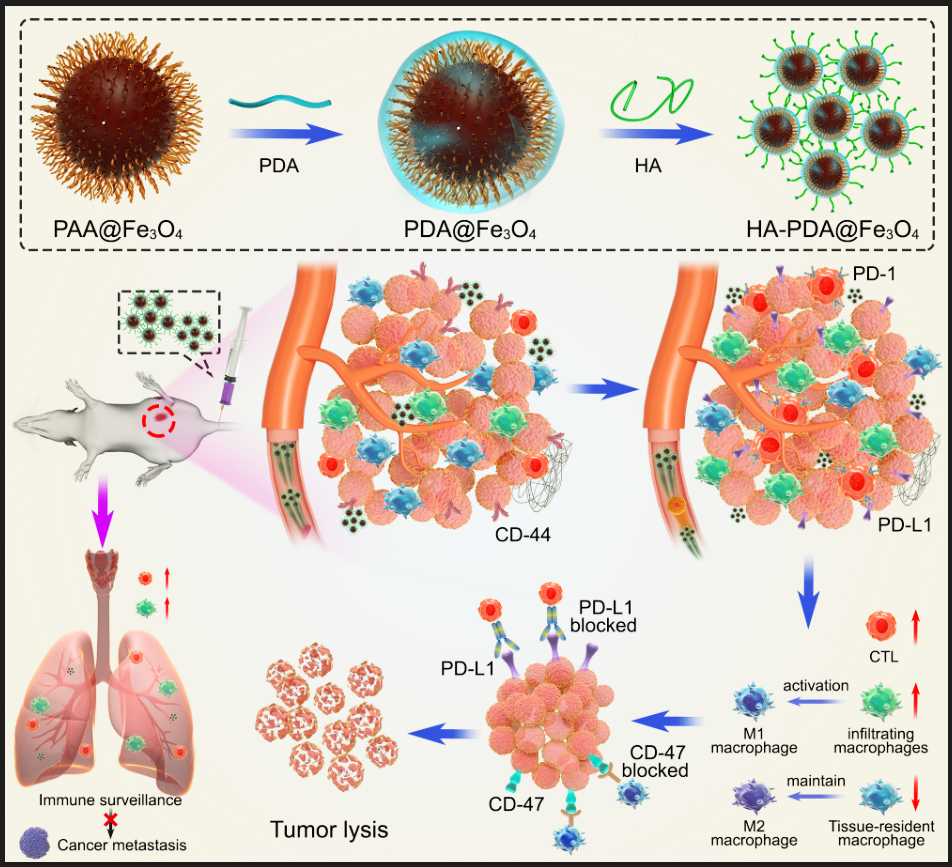
圖1“免疫指針”HA-PDA@Fe3O4招募T細胞並優化巨噬細胞亞型和比例
然而,隨著現代譜系追蹤技術的發展👕,發現TAMs由兩種亞型組成:來源於骨髓單核細胞的浸潤性巨噬細胞和來源於卵黃囊和胎肝的組織駐留型巨噬細胞。而不同來源的TAMs在腫瘤進展中的作用因腫瘤的類型和發展階段而有很大差異,並表現出多層次的激活。這為巨噬細胞療法帶來了挑戰和機遇🪴;然而,如何調節不同來源的TAMs亞型比例以增強癌症免疫治療,以及TAMs亞型對激活劑的響應性是否不同仍不清楚。
近期意昂4体育平台張春富課題組提出通過透明質酸(HA)功能化磁性納米顆粒🧑🏽🦱,構建一種基於鐵氧化物的磁性納米 “免疫指針”🍆。HA是一種細胞外基質成分,能夠靶向各種CD44過表達的腫瘤🕷,並介導多種免疫細胞的粘附和遷移。因此,透明質酸功能化的磁性納米粒子(HA-PDA@Fe3O4)可以高效地在乳腺癌中積累並深入腫瘤實質。腫瘤內高濃度的透明質酸作為“路標”,可以直接招募淋巴細胞,並通過級聯放大效應產生更多的趨化因子,將免疫“冷”腫瘤轉化為“熱”腫瘤。同時,HA-PDA@Fe3O4可以通過募集和激活浸潤性巨噬細胞,同時減少維持M2表型的組織駐留巨噬細胞🧑🏽🔬,有效地重塑腫瘤相關巨噬細胞的多樣性🧍、起源和活化。因此,HA-PDA@Fe3O4協同改善了基於T細胞和巨噬細胞的免疫療法。更為重要的是↙️🥺,HA-PDA@Fe3O4還可以顯著改善肺部免疫微環境,抑製乳腺癌腫瘤肺轉移形成(圖1🩸,2)👴。
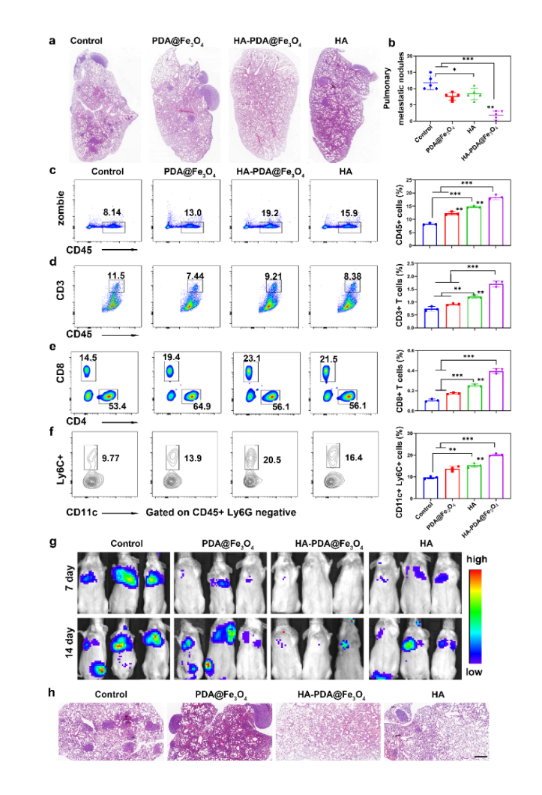
圖2 改善肺部免疫微環境抑製乳腺癌轉移
該研究成果近期在線發表於Advanced Functional Materials(https://doi.org/10.1002/adfm.202009116)🫨。
同時🗞,對於傳統的放化療,由於腫瘤對治療耐受性導致治療失敗👮🏻。該團隊近期研究發現鐵納米氧化物顆粒溫熱應激(45℃)可損害前列腺癌C4-2細胞應對Fe3O4納米顆粒所介導氧化應激下的抗氧化反應,並觸發特定的脂質代謝重編程🛀🏼👨🏻🔧。這種代謝控製行為破壞了腫瘤的氧化還原穩態🤰,並產生了過量的脂質過氧化物🏌🏿♀️,從而引起腫瘤細胞鐵死亡🎦,促使其對傳統治療敏感👮🏿🪚。基於此發現🏌🏻♂️,該團隊進一步設計一種由靶向肽修飾、液態1H-全氟戊烷(1H-PFP)和Fe3O4納米顆粒共包覆體系(GBP@Fe3O4)🎁,提出了一種光熱觸發腫瘤特異性鐵死亡的新策略,並證明乙酰輔酶A合成酶ACSBG1是這一熱誘導鐵死亡策略中的關鍵調控因子,敲除該基因可實現腫瘤細胞死亡命運從鐵死亡向非鐵死亡模式的轉換。相關研究近期發表也於近期在線發表於相關領域重要期刊ACS Nano (https://pubs.acs.org/doi/full/10.1021/acsnano.1c00380)。
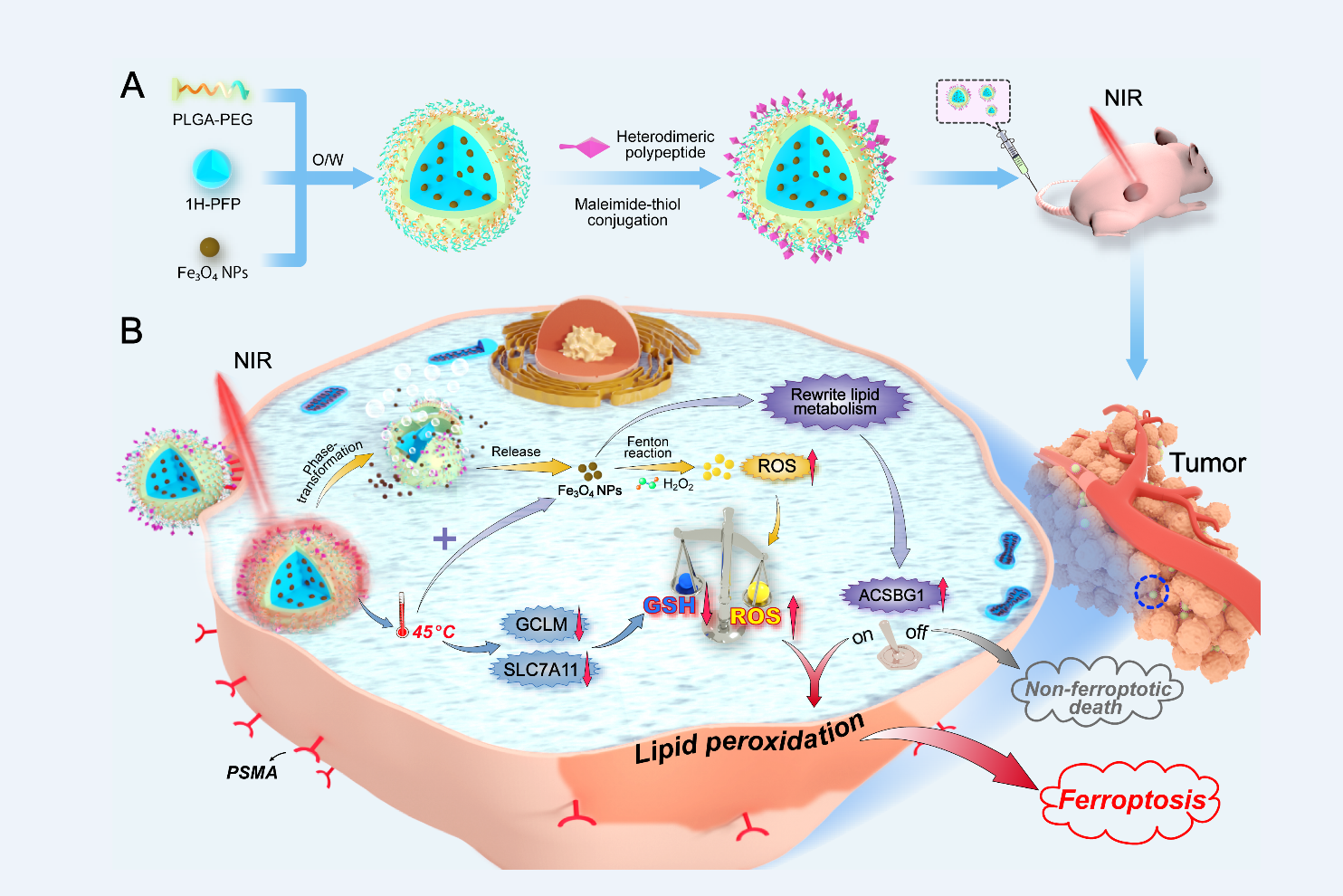
圖3 GBP@Fe3O4合成及腫瘤代謝重編程誘導鐵死亡治療腫瘤機製的示意圖
上述研究拓展了鐵納米氧化物磁性材料在腫瘤診斷和治療方面的應用🦁,對促進腫瘤新興療法和改善傳統療法具有有益的借鑒📏。
供稿單位:科研與學科辦
撰稿人:張春富