腫瘤高攝取葡萄糖,並通過有氧糖酵解的方式獲取能量🫵🏿🧏🏿♀️,這種不同於正常細胞的代謝方式塑造了腫瘤獨特的微環境:弱酸性、乏氧、高過氧化物和抗氧化物含量👊🏼、腫瘤免疫抑製等。腫瘤微環境的這些特征削弱了腫瘤治療,例如腫瘤微環境的乏氧及過量存在的抗氧化物嚴重削弱了腫瘤放療和光動力治療療效;另外😮🤼,腫瘤常規療法(放療和化療)主要通過誘導腫瘤細胞凋亡進行治療,而腫瘤細胞存在多種凋亡抵抗機製,使其對治療產生耐受。因此𓀕,調控腫瘤代謝🫅🏽、重塑腫瘤微環境🧏🏿♀️、以及改造腫瘤細胞命運(如誘導腫瘤細胞發生鐵死亡)可有效增敏多種腫瘤治療模態🙏🏼👨🏻⚕️。
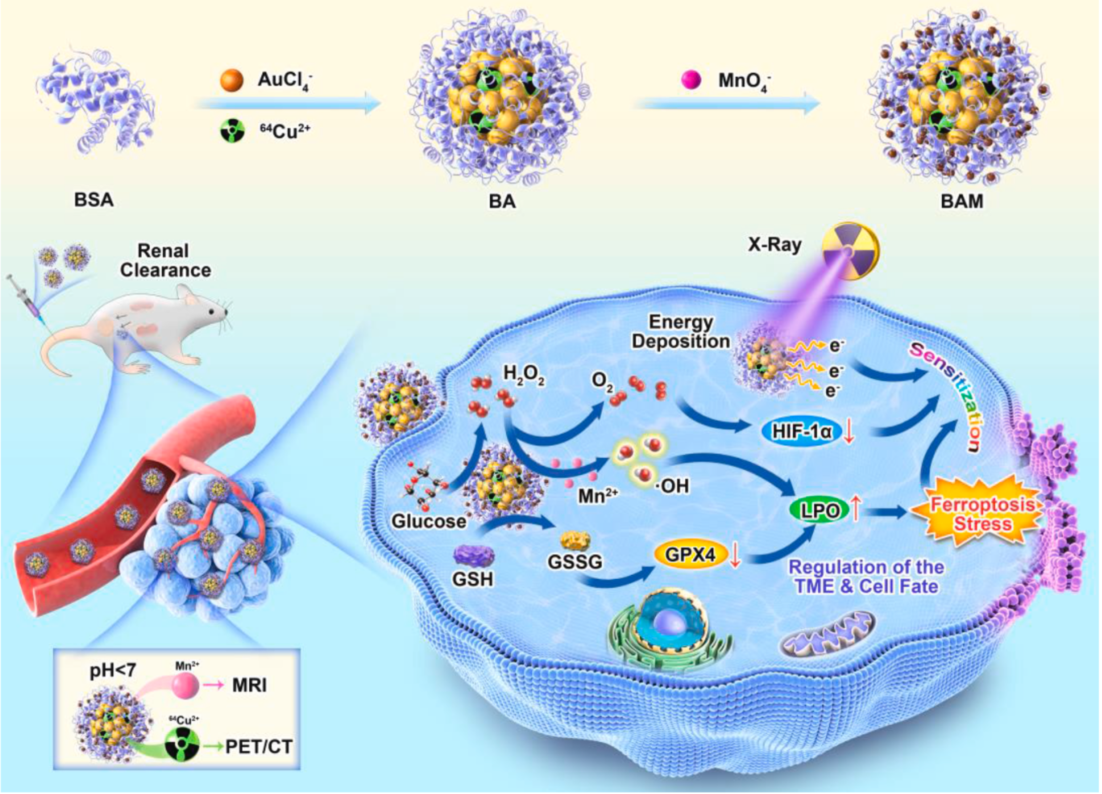
圖1 “核-衛星”結構納米酶的構建及其調控細胞命運示意圖
在前期研究發現鐵氧化物納米顆粒具有高效重塑腫瘤免疫微環境(Advanced Functional Materials 2021 31(23), 2009116)🏄🏼♂️,調控腫瘤細胞命運向鐵死亡應激發展(ACS Nano 2021 15 (4), 7179-7194)的基礎上,近日意昂4体育平台張春富課題組啟迪於生物礦化的方法,構建了超小尺度(< 5 nm)🟣、正電子發射核素銅-64(64Cu)無配體標記的金-錳納米復合酶👇🏽,並首次發現了超小尺度錳氧化物納米顆粒具有強葡萄糖氧化酶性質🚺,可以高效催化分解腫瘤微環境及腫瘤細胞內過量攝取的葡萄糖👷🏿♂️,調控腫瘤糖代謝,並產生過氧化氫。同時,MnO2納米顆粒兼具過氧化物和過氧化氫酶“多酶合一”的性質,可將產生的過氧化氫進一步分解,生成氧氣和羥基自由基,在改善腫瘤乏氧的同時👨🦱,殺死腫瘤細胞🚺。而且高價態的錳離子(Mn4+)能夠氧化腫瘤微環境中的還原性谷胱甘肽(GSH)🎈,打破腫瘤內在的氧化還原動態平衡🚘,從而引起腫瘤內活性氧大量累積,導致細胞膜脂質過氧化🚵🏻♀️,最終誘導腫瘤細胞發生鐵死亡(圖1)🫨。
磁共振成像(MRI)和PET/CT成像顯示該納米酶能夠高效靶向腫瘤,且在腫瘤區域具有高聚集、長滯留的特性👩🏿,而且最終可以通過腎臟代謝清除。協同瘤內乏氧改善及高原子序數金屬(金核)對放療的增敏作用👨🏽⚕️,單次低劑量X-ray輻照放療可實現腫瘤的完全消融🚴🏽♀️,徹底抑製腫瘤的生長(圖2)。
本研究通過合理設計一種自級聯納米酶來調控腫瘤代謝,最終實現腫瘤細胞命運向鐵死亡的重編程,為高效的鐵死亡誘導及鐵死亡介導的腫瘤治療增敏提供了新的思路。

圖2 自級聯納米酶體內成像及腫瘤放療增敏效果研究
同時,二氧化錳納米材料改善腫瘤微環境乏氧狀態也可高效促進腫瘤光動力治療效果👩🏻🦼。相關研究成果於近日相繼發表在Applied Materials Today (https://doi.org/10.1016/j.apmt.2022.101558)和Acta Biomaterialia(https://doi.org/10.1016/j.actbio.2022.04.044)上。
意昂4体育平台博士生吳慶河和張朋利分別為論文的第一作者🏀,張春富為論文通訊作者🈯️。
